Гипертрофическая кардиомиопатия (ГКМП) – это генетически обусловленное заболевание миокарда, проявляющееся комплексом специфических морфо-функциональных изменений и постепенно прогрессирующим течением с высоким риском развития жизнеугрожающих аритмий и внезапной смерти.
ГКМП может диагностироваться в любом возрасте, от первых дней до последней декады жизни, однако преимущественно заболевание выявляется у лиц молодого трудоспособного возраста. Ежегодная смертность больных ГКМП колеблется в пределах от 1 до 6%: у взрослых больных составляет 1-3% , а в детском и подростковом возрасте у лиц с высоким риском внезапной смерти – 4-6%.
1. Классификация
2. Симптомы
3. Объективный осмотр
4. Инструментальные методы исследования
5. Медикаментозное лечение
6. Инвазивные методы лечения
7. Стратификация риска
8. Примеры формулировки диагноза
- Морфофункциональные изменения и причины заболевания
- Классификация гипертрофической кардиомиопатии
- Симптомы ГКМП
- Диагностика гипертрофической кардиомиопатии
- Современные подходы к лечению гипертрофической кардиомиопатии
- Стратификация риска внезапной смерти (ВС) у больных гипертрофической кардиомиопатией
- Примеры формулировок диагноза гипертрофическая кардиомиопатия
Морфофункциональные изменения и причины заболевания
Типичными являются морфологические изменения: аномалия архитектоники сократительных элементов миокарда (гипертрофия и дезориентация мышечных волокон), развитие фибротических изменений мышцы сердца, патология мелких интрамиокардиальных сосудов.
При ГКМП происходит массивная гипертрофия миокарда левого (и реже правого желудочка), чаще асимметричного характера за счет утолщения межжелудочковой перегородки, часто с развитием обструкции выходного тракта левого желудочка (ЛЖ) при отсутствии каких-либо явных причин.
Общепризнанной является представление о преимущественно наследственной природе ГКМП. В связи с этим, широкое распространение получил термин «семейная гипертрофическая кардиомиопатия». К настоящему времени установлено, что более половины всех случаев заболевания являются наследуемыми, при этом основной тип наследования – аутосомно-доминантный. Оставшиеся приходятся на так называемую спорадическую форму; в этом случае у пациента нет родственников, болеющих ГКМП или имеющих гипертрофию миокарда. Считается, что большинство, если не все случаи спорадической ГКМП, также имеют генетическую причину, т. е. вызваны случайными мутациями.
Гипертрофическая кардиомиопатия – это генетически гетерогенное заболевание, причиной которого являются более 200 описанных мутаций нескольких генов, кодирующих белки миофибриллярного аппарата. К настоящему времени известны 10 белковых компонентов сердечного саркомера, выполняющих контрактильную, структурную или регуляторную функции, дефекты которых наблюдаются при ГКМП. Причем в каждом гене множество мутаций могут становиться причиной заболевания (полигенное мультиаллельное заболевание).
Наличие той или иной ассоциированной с ГКМП мутации признается «золотым» стандартом диагностики заболевания. При этом описанные генетические дефекты характеризуются разной степенью пенетрантности, выраженностью морфологических и клинических проявлений. Тяжесть клинической картины зависит от присутствия и степени гипертрофии.
Таким образом, ГКМП характеризуется крайней гетерогенностью вызывающих ее причин, морфологических, гемодинамических и клинических проявлений, разнообразием вариантов течения и прогноза, что существенно затрудняет выбор адекватных и наиболее эффективных лечебных подходов по контролю и коррекции имеющихся нарушений.
Вариабельность прогноза определяет необходимость детальной стратификации риска фатальных осложнений заболевания, поиск доступных прогностических предикторов и критериев оценки проводимого лечения.
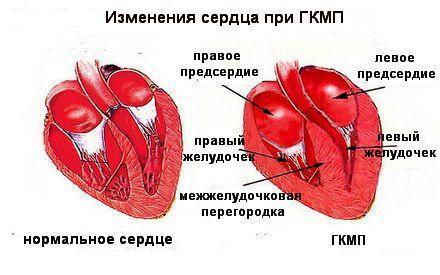
Классификация гипертрофической кардиомиопатии
По анатомическим признакам:
1. асимметричная (95%);
Типы (Маronet а1., 1981):
1) преимущественная гипертрофия верхних (базальных) отделов межжелудочковой перегородки;
2) изолированная гипертрофия межжелудочковой перегородки на всем протяжении;
3) концентрическая гипертрофия левого желудочка — свободной его стенки и перегородки;
4) гипертрофия верхушки сердца (апикальная).
2. симметричную (5%).
По гемодинамическим признакам. В зависимости от наличия или отсутствия градиента систолического давления в полости левого желудочка (по данным ЭХО-кардиографии), отражающего степень обструкции выходного тракта левого желудочка (ЛЖ), выделяют ГКМП:
- обструктивную;
- необструктивную
В зависимости от значений градиента давления, согласно рекомендациям Нью-Йоркской ассоциации кардиологов, выделяют 4 стадии ГКМП:
| Стадии по NYHA | Градиент давления, мм.рт.ст | Субъективные проявления |
| I | менее 25 | Жалоб нет |
| II | менее 36 | Одышка при физической нагрузке |
| III | менее 45 | Одышка, боли в сердце |
| IV | 45 и более | Одышка, боли в сердце, нарушения гемодинамики |
Возможны три гемодинамических варианта обструктивной ГКМП:
- с субаортальной обструкцией в покое (так называемой базальной обструкцией);
- с лабильной обструкцией, характеризующейся значительными спонтанными колебаниями внутрижелудочкового градиента давления без видимой причины;
- с латентной обструкцией, которая вызывается только при нагрузке и провокационных фармакологических пробах (в частности, вдыханием амилнитрита, при приеме нитратов или внутривенном введении изопротеренола).
По течению:
- стабильное, доброкачественное течение ГКМП;
- внезапная смерть;
- прогрессирующее течение — усиление одышки, слабости, утомляемости, болевого синдрома (атипичные боли, стенокардия), появление синкопальных состояний, нарушений систолической дисфункции ЛЖ;
- «конечная стадия» гипертрофической кардиомиопатии — дальнейшее прогрессирование явлений застойной сердечной недостаточности, связанной с ремоделированием и систолической дисфункцией ЛЖ;
- развитие фибрилляции предсердий и связанных с ней осложнений, в частности тромбоэмболических.
Симптомы ГКМП
Cимптомы болезни разнообразны и малоспецифичны, связаны с гемодинамическими нарушениями (диастолическая дисфункция, динамическая обструкция путей оттока, митральная регургитация), ишемией миокарда, патологией вегетативной регуляции кровообращения и нарушением электрофизиологических процессов в сердце. Диапазон клинических проявлений крайне велик: от бессимптомных до неуклонно прогрессирующих и трудно поддающихся медикаментозному лечению форм, сопровождающихся тяжелой симптоматикой.
Повышение диастолического давления в левом желудочке из-за диастолической дисфункции, динамическая обструкция выносящего тракта левого желудочка проявляются одышкой в покое и при физической нагрузке, утомляемости, слабости. Нарастание давления в малом круге кровообращения сопровождается развитием острой левожелудочковой недостаточности (чаще в ночные часы – сердечная астма, альвеолярный отек легких).
Падение фракции выброса при физической нагрузке или нарушениях сердечного ритма сопровождается ухудшением кровообращения головного мозга. Преходящая ишемия мозговых структур проявляется кратковременной потерей сознания (обморок) или предобморочными состояниями (внезапная слабость, головокружение, потемнение в глазах, шум и «заложенность» в ушах).
Диагностика гипертрофической кардиомиопатии
- Объективный осмотр
При осмотре шейных вен может быть хорошо видна выраженная волна А, указывающая на гипертрофию и неподатливость правого желудочка. Сердечный толчок указывает на перегрузку правого желудочка, он может быть заметен при сопутствующей легочной гипертензии.
При пальпации обычно определяется смещение верхушечного толчка влево и его разлитой характер. Вследствие гипертрофии левого желудочка может появляться пресистолический верхушечный толчок, соответствующий IV тону. Возможен тройной верхушечный толчок, третий компонент которого обусловлен позднесистолическим выбуханием левого желудочка.
Пульс на сонных артериях обычно раздвоенный. Быстрый подъем пульсовой волны, за которым следует второй пик, обусловлен усиленным сокращением левого желудочка.
Аускультативно I тон обычно нормальный, ему предшествует IV тон.
II тон может быть нормальным или парадоксально расщепленным из-за удлинения фазы изгнания левого желудочка в результате обструкции его выносящего тракта.
Грубый веретенообразный систолический шум при гипертрофической кардиомиопатии лучше всего слышен вдоль левого края грудины. Он проводится в область нижней трети грудины, но не проводится на сосуды шеи и в подмышечную область.
Важная особенность этого шума – зависимость его громкости и продолжительности от пред- и посленагрузки. При увеличении венозного возврата шум укорачивается и становится тише. При снижении наполнения левого желудочка и при усилении его сократимости шум становится более грубым и продолжительным.
Пробы, влияющие на пред- и посленагрузку, позволяют дифференцировать гипертрофическую кардиомиопатию с другими причинами систолического шума.
- Инструментальные методы исследования
1. ЭХО-КГ – основной метод диагностики ГКМП. Критериями диагностики ГКМП на основании данных ЭХО-КГ являются:
- Асимметричная гипертрофия межжелудочковой перегородки (> 13 мм)
- Переднее систолическое движение митрального клапана
- Маленькая полость левого желудочка
- Гипокинезия межжелудочковой перегородки
- Срединно-систолическое прикрытие аортального клапана
- Внутрижелудочковый градиент давления в покое более 30 мм рт. ст.
- Внутрижелудочковый градиент давления при нагрузке более 50 мм рт. ст.
- Нормо- или гиперкинезия задней стенки левого желудочка
- Уменьшение наклона диастолического прикрытия передней створки митрального клапана
- Пролапс митрального клапана с митральной недостаточностью
- Толщина стенки левого желудочка (в диастолу) более 15 мм
Если в покое обструкции выносящего тракта левого желудочка нет, ее можно спровоцировать медикаментозными (ингаляция амилнитрита, введение изопреналина, добутамина) или функциональными пробами (проба Вальсальвы, физическая нагрузка), которые уменьшают преднагрузку или повышают сократимость левого желудочка.
Читать также Стенокардия — классификация, причины, симптомы, диагностика, лечение
2. ЭКГ-исследование
Патогномоничных для гипертрофической кардиомиопатии ЭКГ-признаков нет. Могут отмечаться: отклонение электрической оси сердца влево, признаки гипертрофии предсердий, QII, III, aVF, V5-V6, отрицательные гигантские Т в грудных отведениях (характерно для апикальной гипертрофии ЛЖ – болезни Ямагучи), короткий интервал PQ с деформацией начальной части QRS.

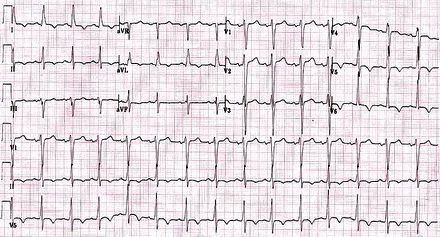
Гипертрофическая Обструктивная Кардиомиопатия. Критерии, характерные для ГЛЖ SV2+ RV5 > 35mV. Инверсия зубца ТV5-V6 часто бывает при апикальном варианте ГКМП.
3. Магнитно-резонансная томография (МРТ)
Основные преимущества МРТ при гипертрофической кардиомиопатии – высокое разрешение, отсутствие облучения и необходимости введения контрастных веществ, возможность получить трехмерное изображение, оценить структуру ткани. К недостаткам относится высокая стоимость, продолжительность исследования и невозможность выполнения МРТ у некоторых больных, например при имплантированных дефибрилляторах или кардиостимуляторах. МРТ с разметкой миокарда – относительно новый метод, который дает возможность проследить путь определенных точек миокарда в систолу и диастолу. Это позволяет оценить сократимость отдельных участков миокарда и тем самым выявить области преимущественного поражения.
4. Катетеризация сердца и коронарная ангиография при гипертрофической кардиомиопатии проводятся для оценки коронарного русла перед миоэктомией или операцией на митральном клапане, а также чтобы выяснить причину ишемии миокарда. При этом к характерным признакам ГКМП относят:
- Внутрижелудочковый градиент давления на уровне средних сегментов левого желудочка или его выносящего тракта
- Кривая давления в аорте вида пик-купол (в результате обструкции выносящего тракта левого желудочка)
- Повышение диастолического давления в желудочках
- Повышение ДЗЛА
- Высокая волна V на кривой ДЗЛА (Может возникать как из-за митральной регургитации, так и из-за повышения давления в левом предсердии.)
- Повышение давления в легочной артерии
5. Сцинтиграфия миокарда и позитронно-эмиссионная томография
При гипертрофической кардиомиопатии сцинтиграфия миокарда имеет некоторые особенности, однако в целом ее значение в диагностике ишемии такое же, как и обычно. Стойкие дефекты накопления указывают на рубцовые изменения после инфаркта миокарда, обычно они сопровождаются снижением функции левого желудочка и плохой переносимостью физической нагрузки. Обратимые дефекты накопления указывают на ишемию, вызванную снижением коронарного резерва при нормальных артериях или коронарным атеросклерозом. Обратимые дефекты часто никак не проявляются, однако, по-видимому, они повышают риск внезапной смерти, особенно у молодых больных с гипертрофической кардиомиопатией. При изотопной вентрикулографии можно выявить замедленное наполнение левого желудочка и удлинение периода изоволюмического расслабления.
Позитронно-эмиссионная томография – более чувствительный метод, кроме того, она позволяет учесть и устранить помехи, связанные с затуханием сигнала. Позитронно-эмиссионная томография с фтордезоксиглюкозой подтверждает наличие субэндокарлиальной ишемии, вызванной снижением коронарного резерва.
Современные подходы к лечению гипертрофической кардиомиопатии
(по материалам статьи «Современные подходы к лечению больных гипертрофической кардиомиопатией». Авторы: С. А. Габрусенко, Ю. В. Сафрыгина, В.Г.Наумов, Ю.Н.Беленков)
По современным представлениям, лечебная стратегия определяется в процессе разделения больных на категории в зависимости от описанных выше вариантов течения и прогноза.
Все лица с ГКМП, включая носителей патологических мутаций без фенотипических проявлений болезни и пациентов с бессимптомным течением заболевания, нуждаются в динамическом наблюдении, в ходе которого оцениваются характер и выраженность морфологических и гемодинамических нарушений. Особое значение имеет выявление факторов, определяющих неблагоприятный прогноз и повышенный риск внезапной смерти (в частности, скрытых, прогностически значимых аритмий).
- Общие мероприятия
Ограничение значительных физических нагрузок и запрещение занятий спортом, способных вызывать усугубление гипертрофии миокарда, повышение внутрижелудочкового градиента давления и риска внезапной смерти.
- Медикаментозное лечение
До настоящего времени окончательно не решен вопрос о необходимости проведения активной медикаментозной терапии у наиболее многочисленной группы больных с бессимптомной или малосимптомной формами ГКМП и низкой вероятностью внезапной смерти. Противники активной тактики обращают внимание на то, что при благоприятном течении заболевания продолжительность жизни и показатели смертности не отличаются от таковых в общей популяции. Некоторые же авторы указывают на то, что использование в этой группе пациентов β-адреноблокаторов и антагонистов кальция (верапамил) может приводить к сдерживанию гемодинамических нарушений и клинической симптоматики. При этом никто не оспаривает тот факт, что выжидательная тактика в случаях бессимптомного или малосимптомного течения ГКМП возможна лишь при отсутствии признаков внутрижелудочковой обструкции, обмороков и серьезных нарушений сердечного ритма, отягощенной наследственности и случаев ВС у близких родственников.
Следует признать, что лечение ГКМП, генетически обусловленного заболевания, обычно распознаваемого на поздней стадии, пока может быть в большей степени симптоматическим и паллиативным. Тем не менее к основным задачам лечебных мероприятий относятся не только профилактика и коррекция основных клинических проявлений заболевания с улучшением качества жизни пациентов, но и положительное влияние на прогноз, предупреждение случаев ВС и прогрессирования заболевания.
Основу медикаментозной терапии ГКМП составляют препараты с отрицательным инотропным действием: β-адреноблокаторы и блокаторы кальциевых каналов. Для лечения весьма распространенных при этом заболевании нарушений сердечного ритма используются также дизопирамид (антиаритмический препарат IA класса) и амиодарон.
β-адреноблокаторы стали первой, и остаются и по сей день, наиболее эффективной группой лекарственных средств, применяемых в лечении ГКМП. Они оказывают хороший симптоматический эффект в отношении основных клинических проявлений: одышки и сердцебиения, болевого синдрома, включая стенокардию, не менее чем у половины больных с гипертрофической кардиомиопатией, что обусловлено, в основном, способностью этих препаратов уменьшать потребность миокарда в кислороде. Благодаря отрицательному инотропному действию и уменьшению активации симпатоадреналовой системы при физическом и эмоциональном напряжении, β-блокаторы предотвращают возникновение или повышение субаортального градиента давления у больных с латентной и лабильной обструкцией, существенно не влияя на величину этого градиента в покое. Убедительно доказана способность β-блокаторов улучшать функциональный статус пациентов в условиях курсового и длительного применения. Хотя препараты не оказывают прямого влияния на диастолическое расслабление миокарда, они могут улучшать наполнение ЛЖ косвенно — за счет уменьшения частоты сердечных сокращений и предупреждения ишемии сердечной мышцы. В литературе имеются данные, подтверждающие способность β-блокаторов сдерживать и даже приводить к обратному развитию гипертрофии миокарда. Однако другие авторы подчеркивают, что вызываемое β-блокаторами симптоматическое улучшение не сопровождается регрессией гипертрофии ЛЖ и улучшением выживаемости больных. Хотя эффект этих препаратов в отношении купирования и предупреждения желудочковых и суправентрикулярных аритмий и внезапной смерти не доказан, ряд специалистов все же считают целесообразным их профилактическое назначение больным ГКМП высокого риска, включая пациентов молодого возраста с отягощенным случаями внезапной смерти семейным анамнезом.
Предпочтение отдается β-блокаторам без внутренней симпатомиметической активности. Наибольший опыт накоплен по применению пропранолола (обзидан, анаприлин). Его назначают начиная с 20 мг 3-4 раза в день, с постепенным увеличением дозы под контролем пульса и артериального давления (АД) до максимально переносимой в большинстве случаев 120–240 мг/сут. Следует стремиться к применению возможно более высоких доз препарата, так как отсутствие эффекта терапии β-блокаторами, вероятно, связано с недостаточной дозировкой. При этом нельзя забывать о том, что повышение дозировок существенно увеличивает риск известных побочных эффектов.
В настоящее время широко изучается возможность эффективного применения нового поколения кардиоселективных β-блокаторов пролонгированного действия, в частности атенолола, конкора и др. При этом существует мнение о том, что кардиоселективные β-блокаторы у больных ГКМП не имеют преимуществ перед неселективными, так как в больших дозах, к достижению которых следует стремиться, селективность практически утрачивается. Следует отметить, что рекомендуемый к применению у больных ГКМП с тяжелыми суправентрикулярными и желудочковыми аритмиями соталол сочетает в себе свойства неселективных β-блокаторов и антиаритмических средств III класса (кордароноподобный эффект).
Применение блокаторов медленных кальциевых каналов при гипертрофической кардиомиопатии основано на снижении уровня свободного кальция в кардиомиоцитах и нивелировании асинхронии их сокращения, улучшении расслабления миокарда и снижении его сократимости, подавлении процессов гипертрофии миокарда. Среди блокаторов кальциевых каналов препаратом выбора, благодаря наибольшей выраженности отрицательного инотропного действия и наиболее оптимальному профилю фармакологических свойств, является верапамил (изоптин, финоптин). Он обеспечивает симптоматический эффект у 65–80% больных, включая случаи рефрактерности к лечению β-блокаторами, что обусловлено способностью препарата уменьшать ишемию миокарда, в том числе безболевую, и улучшать его диастолическое расслабление и податливость ЛЖ. Это свойство верапамила обеспечивает повышение толерантности больных к физической нагрузке и снижение субаортального градиента давления в покое при меньшей по сравнению с β-блокаторами способности к уменьшению внутрижелудочковой обструкции в случаях физического и эмоционального напряжения и провокации изопротеренолом. Одновременно верапамил снижает периферическое сосудистое сопротивление вследствие вазодилататорного действия. И хотя этот эффект чаще всего нивелируется непосредственным положительным влиянием на диастолическую функцию левого желудочка, у отдельных больных с базальной внутрижелудочковой обструкцией в сочетании с повышенным конечно-диастолическим давлением ЛЖ и склонностью к системной артериальной гипотензии при уменьшении постнагрузки внутрижелудочковый градиент давления может резко возрастать. Это способно приводить к развитию отека легких, кардиогенного шока и даже внезапной смерти. Подобные грозные осложнения фармакотерапии верапамилом описаны также у больных необструктивной ГКМП с высоким давлением в левом предсердии, у которых они обусловлены отрицательным инотропным действием препарата. Очевидно, как важно соблюдать осторожность при начале лечения верапамилом этой категории больных. Прием препарата следует начинать в условиях стационара с малых доз — 20-40 мг 3 раза в день с постепенным их повышением при хорошей переносимости до снижения частоты сердечных сокращений в покое до 50-60 уд/мин. Клинический эффект наступает обычно при приеме не менее 160–240 мг препарата в сутки; более удобны в условиях длительного применения пролонгированные формы (изоптин-ретард, верогалид-ретард). С учетом благоприятного влияния верапамила на диастолическую функцию и величину субаортального градиента давления в ЛЖ, а также доказанной способности увеличивать выживаемость больных гипертрофической кардиомиопатией по сравнению с плацебо, целесообразно его профилактическое назначение у асимптоматичных больных ГКМП высокого риска.
Читать также Митральный стеноз — причины, симптомы, лечение, диагностика, классификация
Место дилтиазема в лечении ГКМП окончательно не определено. Имеются данные, что в средней дозе 180 мг/сут за 3 приема он оказывает столь же выраженное, как 240 мг верапамила, благотворное влияние на диастолическое наполнение ЛЖ и одинаковый симптоматический эффект, однако в меньшей степени улучшает физическую работоспособность больных.
В Институте кардиологии им. А. Л. Мясникова РКНПК МЗ РФ прводилось проспективное наблюдение (от 1 до 5 лет) более 100 больных ГКМП. Больные были рандомизированы на 3 сопоставимые по количеству, полу, возрасту и тяжести клинических проявлений группы. Пациентам произвольно назначались атенолол или изоптин-ретард; в третьей группе преобладали лица с тяжелыми желудочковыми нарушениями ритма, и им был рекомендован прием соталола. Оценка эффективности различных вариантов медикаментозного лечения проводилась в условиях длительного (не менее 1 года) применения препаратов. Суточные дозы при двухкратном режиме приема титровались индивидуально и составили в среднем 85, 187, 273 мг для атенолола, изоптина и соталола соответственно. Длительная терапия привела к улучшению клинического состояния соответственно у 77, 72 и 83% пациентов каждой группы, что выражалось в достоверном уменьшении основных симптомов, проявлений сердечной недостаточности (СН), увеличении мощности и времени выполненной нагрузки и улучшении показателей качества жизни (на 25, 32 и 34% соответственно). При этом выявлены достоверное (p < 0,01) снижение ЧСС в покое и на пике физической нагрузки, положительная динамика показателей перфузии миокарда и показателей диастолической функции. Достоверных изменений основных эхокардиографических показателей на фоне лечения не регистировалось, отмечена тенденция к уменьшению градиента давления в выносящем тракте левого желудочка у больных с обструктивной ГКМП. При этом у больных с исходно тяжелыми нарушениями диастолической функции ЛЖ (рестриктивный и «псевдонормальный» тип трансмитрального потока) терапия оказалась малоэффективной.
Таким образом, длительная терапия атенололом, изоптином и соталолом оказывает сходное благоприятное влияние на состояние большинства больных гипертрофической кардиомиопатией: уменьшает клинические проявления заболевания, улучшает функциональное состояние и качество жизни, что связано с их положительным влиянием на гемодинамику и перфузию миокарда.
Следует отметить, что β-адреноблокаторы (за исключением соталола) и антагонисты кальция обладают слабой антиаритмической активностью, в то время как частота опасных желудочковых и суправентрикулярных аритмий у больных ГКМП чрезвычайно велика. Поэтому актуально применение у этой категории больных антиаритмических препаратов, в ряду которых наиболее популярным и рекомендуемым ведущими специалистами является дизопирамид.
Дизопирамид (ритмилен), относящийся к антиаритмикам IA класса, обладает выраженным отрицательным инотропным эффектом, у больных ГКМП способен снижать уровень обструкции выходного тракта ЛЖ, положительно влияет на структуру диастолы. Эффективность длительного лечения дизопирамидом доказана в отношении больных ГКМП с умеренной обструкцией оттока из ЛЖ. Особенно выгодно использовать этот препарат у больных с желудочковыми аритмиями. Начальная доза обычно составляет 400 мг/сут с постепенным увеличением до 800 мг. При этом, как и в случае назначения соталола, необходимо контролировать продолжительность интервала Q-T по ЭКГ.
Не менее эффективным средством лечения и профилактики как желудочковых, так и суправентрикулярных аритмий при ГКМП является амиодарон (кордарон), который наряду с антиаритмической активностью, по-видимому, несколько уменьшает гиперконтрактильность и ишемию миокарда. Более того, по мнению W. McKenna et al., показана его способность предотвращать у таких больных внезапную смерть. Лечение амиодароном начинают с насыщающих доз (600–1200 мг/сут) в течение 3–7 дней с постепенным, по мере уменьшения частоты сердечных сокращений, снижением до поддерживающей (желательно 200 мг/сут и менее). Учитывая отложение препарата в тканях с возможным нарушением функции щитовидной железы, развитием пневмофиброза, поражения роговицы, кожи и печени, при его длительном (более 10–12 мес.) приеме необходим регулярный контроль состояния этих «уязвимых» органов с целью раннего выявления возможных осложнений фармакотерапии.
При ГКМП возможны комбинации препаратов, обладающих отрицательным инотропным эффектом, например β-блокаторов и антагонистов кальция, b-блокаторов и дизопирамида.
Признаки венозного застоя в легких, включая ночные приступы сердечной астмы, при гипертрофической кардиомиопатии не являются редкостью и в большинстве случаев обусловлены диастолической дисфункцией ЛЖ. Таким больным показано лечение β-блокаторами или антагонистами кальция в сочетании с осторожным применением салуретиков. Периферических вазодилататоров, включая нитраты, и сердечных гликозидов следует избегать из-за опасности ухудшения диастолического наполнения ЛЖ и резкого снижения сердечного выброса, вплоть до развития синкопе и внезапной смерти.
Различные суправентрикулярные тахиаритмии, главным образом мерцание и трепетание предсердий, отмечаются у 10–30% больных ГКМП и обусловливают опасность возникновения или усугубления нарушений кардиогемодинамики, возникновение тромбоэмболий, а также повышенный риск развития фибрилляции желудочков в связи с частой сопутствующей дисфункцией атриовентрикулярного соединения и наличием добавочных проводящих путей между предсердиями и желудочками. Вследствие этого у больных ГКМП пароксизмальные суправентрикулярные аритмии относят к категории потенциально фатальных, а скорейшее восстановление синусового ритма и предупреждение повторных пароксизмов приобретают особенно важное значение.
Для купирования пароксизмов мерцательной аритмии, кроме антиаритмических препаратов IА группы и амиодарона используют β-блокаторы, верапамил и дигоксин, при неэффективности которых прибегают к электроимпульсной терапии. При постоянной форме мерцательной аритмии для контроля частоты сокращений желудочков применяют β-блокаторы или верапамил в сочетании с дигоксином. Это единственный случай, когда больным обструктивной гипертрофической кардиомиопатией можно назначать сердечные гликозиды, не опасаясь повышения внутрижелудочкового градиента давления. Поскольку мерцательная аритмия у больных ГКМП связана с высоким риском системных тромбоэмболий, в том числе инсульта, сразу после ее развития необходимо начинать терапию антикоагулянтами, которые при постоянной форме мерцания предсердий принимают неопределенно долго.
К сожалению, у значительного числа больных ГКМП традиционная фармакотерапия не позволяет эффективно контролировать симптоматику заболевания, низкое качество жизни не устраивает пациентов. В таких случаях приходится решать вопрос о возможности использования иных, не медикаментозных лечебных подходов. При этом дальнейшая тактика определяется отдельно у больных с обструктивной и необструктивной формами ГКМП.
Читать также Причины и последствия пониженного артериального давления
Вопреки распространенному представлению, нередко в далеко зашедшей стадии патологического процесса (преимущественно при необструктивной форме ГКМП) развивается прогрессирующая систолическая дисфункция и тяжелая сердечная недостаточность, ассоциированная с ремоделированием ЛЖ (утончением его стенок и дилатацией полости). Такая эволюция заболевания наблюдается у 2–5% больных ГКМП и характеризует конечную («дилатационную») стадию особого, тяжело и ускоренно протекающего процесса, не зависящего от возраста пациента и давности манифестации болезни. Увеличение систолического размера ЛЖ обычно опережает диастолическое расширение и преобладает над ним. Клиническими особенностями этой стадии являются выраженная, нередко рефрактерная застойная СН и исключительно плохой прогноз. Лечебная стратегия в отношении таких больных меняется и строится на общих принципах терапии застойной СН, предусматривает осторожное назначение ингибиторов АПФ и блокаторов рецепторов ангиотензина II, диуретиков и сердечных гликозидов, β-блокаторов и спиронолактона. Эти пациенты являются кандидатами на проведение трансплантации сердца.
- Инвазивные методы лечения ГКМП
1. Чрезаортальная септальная миэктомия
При отсутствии клинического эффекта от активной медикаментозной терапии симптоматичным больным III-IV функционального класса по классификации Нью-Йоркской ассоциации кардиологов с выраженной асимметричной гипертрофией МЖП и субаортальным градиентом давления в покое, равным 50 мм рт. ст. и более, показано хирургическое лечение. Классическая методика — чрезаортальная септальная миэктомия, предложенная Agmorrow. У больных молодого возраста с семейным анамнезом ГКМП с тяжелыми клиническими проявлениями и указанием на раннюю ВС у родственников показания для больного должны быть расширены. В некоторых центрах она проводится также в случаях значительной латентной обструкции. В целом, потенциальными кандидатами для проведения оперативного лечения являются не менее 5% из числа всех больных ГКМП. Операция обеспечивает хороший симптоматический эффект с полным устранением или значительным уменьшением внутрижелудочкового градиента давления у 95% больных и значительным снижением конечно-диастолического давления в ЛЖ у 66% больных. Хирургическая летальность в настоящее время составляет около 1-2%, что сопоставимо с ежегодной летальностью при медикаментозной терапии (2-5%). Хотя в ходе большинства более ранних исследований не удавалось обнаружить существенного влияния хирургического лечения гипертрофической кардиомиопатии на прогноз, в работах С. Seiler et al. показано улучшение 10-летней выживаемости оперированных больных до 84% по сравнению с 67% в группе лечившихся медикаментозно. Имеются сообщения о 40-летнем наблюдении после проведенной миэктомии.
2. Вальвулопластики или протезирования митрального клапана
В ряде случаев при наличии дополнительных показаний для уменьшения выраженности обструкции и митральной регургитации одномоментно выполняется операция вальвулопластики или протезирования митрального клапана низкопрофильным протезом. Улучшить отдаленные результаты миэктомии позволяет последующая длительная терапия верапамилом, обеспечивающая улучшение диастолической функции ЛЖ, что не достигается при хирургическом лечении.
3. Иссечения межжелудочковой перегородки
В настоящее время разработаны и успешно применяются отличные от классической миэктомии методики. В частности, в НЦССХ им. А. Н. Бакулева под руководством академика Л. А. Бокерия разработана оригинальная методика иссечения зоны гипертрофированной МЖП из конусной части правого желудочка. Этот способ хирургической коррекции обструктивной ГКМП является высокоэффективным и может стать методом выбора в случаях одновременной обструкции выходных отделов обоих желудочков, а также в случаях среднежелудочковой обструкции ЛЖ.
4. Двукамерная электрокардиостимуляция
В последние годы растущий интерес вызывает изучение возможности использования в качестве альтернативы хирургическому лечению больных обструктивной ГКМП последовательной двухкамерной электрокардиостимуляции с укороченной атриовентрикулярной задержкой. Вызываемое таким образом изменение последовательности распространения волны возбуждения и сокращения желудочков, которая охватывает вначале верхушку, а затем МЖП, приводит к уменьшению субаортального градиента благодаря снижению регионарной сократимости МЖП и, как следствие, расширению выносящего тракта ЛЖ. Этому способствуют также запаздывание систолического движения кпереди передней створки МК и уменьшение его амплитуды. Важное значение имеет подбор наименьшего интервала времени задержки нанесения желудочкового импульса после предсердного, которая обеспечивает преждевременную деполяризацию верхушки сердца, не приводя при этом к ухудшению кардиогемодинамики — снижению сердечного выброса и АД. Для этого в ряде случаев приходится прибегать к удлинению времени спонтанной атриовентрикулярной проводимости с помощью терапии β-блокаторами или верапамилом и даже аблации атриовентрикулярного узла. Хотя первоначальные неконтролируемые наблюдения были весьма обнадеживающими, более поздние рандомизированные исследования показали, что достигаемые при такой электрокардиостимуляции симптоматический эффект и снижение субаортального градиента давления (около 25%) относительно невелики, а существенные изменения физической работоспособности вообще отсутствуют. Не удалось обнаружить и существенного влияния электрокардиостимуляции на частоту внезапной смерти. Обеспокоенность вызывают усугубление нарушения диастолического расслабления миокарда и повышение конечно-диастолического давления в ЛЖ. Очевидно, что до уточнения роли электрокардиостимуляции в лечении обструктивной ГКМП расширенное клиническое применение этого метода не рекомендуется.
5. Транскатетерная септальная аблация
Другим альтернативным методом лечения рефракторной обструктивной гипертрофической кардиомиопатии является транскатетерная алкогольная септальная аблация. Методика предполагает инфузию через баллонный катетер в перфорантную септальную ветвь 1–3 мл 95% спирта, вследствие чего возникает инфаркт гипертрофированного отдела МЖП, захватывающей от 3 до 10% массы миокарда ЛЖ (до 20% массы МЖП). Это приводит к значимому уменьшению выраженности обструкции выходного тракта и митральной недостаточности, объективной и субъективной симптоматике заболевания. При этом в 5–10% случаев возникает необходимость имплантации постоянного ЭКС в связи с развитием атриовентрикулярной блокады высокой степени. Кроме того, к настоящему времени не доказано положительное влияние транскатетерной аблации на прогноз, а операционная смертность (1-2%) не отличается от таковой при проведении операции септальной миэктомии, считающейся на сегодняшний день «золотым стандартом» лечения больных ГКМП с выраженной симптоматикой и обструкцией выходного тракта ЛЖ, резистентных к фармакотерапии.
Стратификация риска внезапной смерти (ВС) у больных гипертрофической кардиомиопатией
По мнению большинства авторов, неоспоримыми факторами высокого риска ВС при ГКМП являются: молодой возраст (< 14 лет); наличие в анамнезе у больных обмороков и тяжелых желудочковых нарушений ритма, эпизодов неустойчивой желудочковой тахикардии по результатам суточного ЭКГ-мониторирования; неадекватность прироста артериального давления в ходе нагрузочного теста; выраженная (более 3 см) гипертрофия миокарда ЛЖ; указание на ГКМП и/или внезапную смерть в семейном анамнезе. Кроме того, некоторые исследователи считают, что вероятность ВС повышается при наличии у больного фибрилляции предсердий, выраженной ишемии миокарда и обструкции выходного тракта ЛЖ. Большое значение придается обнаружению у больных с семейным характером заболевания мутаций, ассоциированных с тяжелым прогнозом. Установление высокого риска ВС определяет необходимость особой, более активной врачебной тактики в отношении этой категории пациентов (уточнение лекарственной терапии, использование пейсмейкеров, дефибрилляторов-кардиовертеров, проведение хирургических вмешательств). При этом наиболее адекватным лечебным мероприятием является имплантация дефибриллятора-кардиовертера с целью первичной или вторичной профилактики жизнеугрожающих аритмий и, в конечном счете, улучшения прогноза.
Таким образом, стратегия лечебных мероприятий при ГКМП достаточно сложна и предполагает индивидуальный анализ всего комплекса клинических, анамнестических, гемодинамических показателей, результатов генной диагностики и стратификации риска ВС, оценку особенностей течения заболевания и эффективности используемых вариантов лечения.
В целом, рациональная фармакотерапия в сочетании с хирургическим лечением и электрокардиотерапией позволяет получить хороший клинический эффект, предупредить возникновение тяжелых осложнений и улучшить прогноз у значительной части больных гипертрофической кардиомиопатией.
Примеры формулировок диагноза гипертрофическая кардиомиопатия
1. Асимметричная ГКМП, обструктивная форма, градиент внутрижелудочковой обструкции II степени, стадия декомпенсации, НК II степени (NYHA…), нарушение ритма сердца – суправентрикулярная тахикардия, семейный вариант.
2. Асимметричная ГКМП, обструктивная форма, градиент внутрижелудочковой обструкции I степени, стадия субкомпенсации, НК 0 степени (NYHA…), семейный вариант.
3. Симметричная ГКМП, необструктивная форма, стадия компенсации, NYHA….ФК
4. Симметричная концентрическая ГКМП, обструктивная форма, стадия декомпенсации, NYHA….ФК